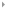化学系王梅祥教授研究组在环带烃类化合物的合成领域取得重要进展
时间:2020-04-16 16:31:00
近期,清华大学化学系王梅祥教授研究组在环带烃类化合物的合成领域取得突破,研究成果相继发表在今年的《美国化学会志》(J. Am. Chem. Soc. 2020, 142, 1196-1199;J. Am. Chem. Soc. 2020, 142, 4576-4580)与《德国应用化学》(Angew. Chem. Int. Ed. 2020, 59, DOI: 10.1002/anie.202002827.)上,引起国际同行的关注与好评。
化学家们对于具有优美结构和独特性能的“非天然产物”的研究热情由来已久,如对环带烃分子的关注和研究可追溯到上世纪50年代。环带烃类分子是由碳环稠合而成的双链大环化合物。从并环类型上看,可以分为锯齿型(zigzag)A、扶手椅型(armchair)B和螺旋型(chiral)C(图1)。从形式上的碳-碳键的类型来看,环带烃包括完全共轭的、部分共轭的和完全饱和的分子。因为奇异的分子结构和理论所预测的优越理化性能,环带烃分子被提出后,包括2016年诺贝尔化学奖获得者Stoddart教授在内的合成化学家,在上世纪80年代后期便尝试这些化合物的“人工全合成”。自1991年碳纳米管被发现以来,由于上述三种环带烃可分别看成是锯齿型、扶手椅型和螺旋型单壁碳纳米管的最短单元,可能作为模板或晶种生长结构均匀的单壁碳纳米管,更是引发了一股对环带烃类分子的研究热潮。得益于2008年Jasti和Bertozzi在环对苯撑(cyclo-para-phenylenes,简称CPPs)合成方法的开拓性研究和贡献,近年,日本学者Itami和Isobe等在日本ERATO计划的强力资助下,率先合成了扶手椅型(B)的环带烃分子。最近螺旋型环带烃(C)也被成功合成。然而,由于缺乏有效的合成方法以及理论所预测的高张力和开壳层性质,锯齿型(A)环带烃的稳定性不高,合成研究长期停滞不前,全共轭的锯齿型环带芳烃更是从未有过报道。
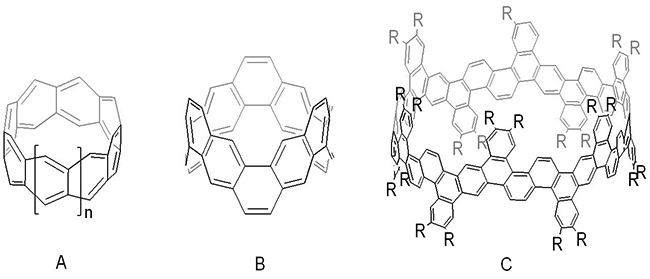
图1. 锯齿型,扶手椅型以及螺旋型环带芳烃结构
王梅祥课题组建立和发展了全新和通用的“跨湾造桥” 策略和多重分子内反应方法,充分利用唢芳烃本身预组织的单环结构和所具有的锥式构象,通过在 唢芳烃“湾区”的位点装配合适的反应基团,随后一步实现4个或6个跨越“湾区”的化学桥联反应,高效地构建了不同类型骨架结构的环带分子,通过“成带”后化学修饰,合成各种环带烃化合物,并首次观测到全共轭的环带芳烃化合物的形成,在环带烃研究方面取得进展。
唢芳烃“湾区”的位点装配合适的反应基团,随后一步实现4个或6个跨越“湾区”的化学桥联反应,高效地构建了不同类型骨架结构的环带分子,通过“成带”后化学修饰,合成各种环带烃化合物,并首次观测到全共轭的环带芳烃化合物的形成,在环带烃研究方面取得进展。
首先,他们利用廉价易得的 唢[4]芳烃与
唢[4]芳烃与 唢[6]芳烃作为原料,经酚羟基的三氟甲磺酰化及Stille偶联反应构建了多烯基取代的大环中间体,随后通过分子内的关环烯烃复分解反应(RCM)构建了环带[n]芳烃[n]
唢[6]芳烃作为原料,经酚羟基的三氟甲磺酰化及Stille偶联反应构建了多烯基取代的大环中间体,随后通过分子内的关环烯烃复分解反应(RCM)构建了环带[n]芳烃[n] 烯(n = 4, 6)。通过环带[4]芳烃[4]
烯(n = 4, 6)。通过环带[4]芳烃[4] 烯化合物的选择性催化氢化,实现烯烃双键彻底还原以及部分苯环的还原,合成了高度不饱和的环带烃衍生物。合成中,每步转化反应涉及8或12个反应位点,反应条件温和、总体效率高,原料廉价易得,是一个合成不同大小尺寸环带烃的实用方法。环带[n]芳烃[n]
烯化合物的选择性催化氢化,实现烯烃双键彻底还原以及部分苯环的还原,合成了高度不饱和的环带烃衍生物。合成中,每步转化反应涉及8或12个反应位点,反应条件温和、总体效率高,原料廉价易得,是一个合成不同大小尺寸环带烃的实用方法。环带[n]芳烃[n] 烯具有独特的圆台锥结构和空腔,最大内径达1纳米左右(图2),作为富电子空腔的主体分子,可以选择性地包合有机小分子。此外,环带[n]芳烃[n]
烯具有独特的圆台锥结构和空腔,最大内径达1纳米左右(图2),作为富电子空腔的主体分子,可以选择性地包合有机小分子。此外,环带[n]芳烃[n] 烯及衍生物可望作为模板,生长具有异质结的碳纳米管。该成果发表在《美国化学会志》上(J. Am. Chem. Soc. 2020, 142, 1196-1199.),清华大学博士生张乾为本文的第一作者。
烯及衍生物可望作为模板,生长具有异质结的碳纳米管。该成果发表在《美国化学会志》上(J. Am. Chem. Soc. 2020, 142, 1196-1199.),清华大学博士生张乾为本文的第一作者。
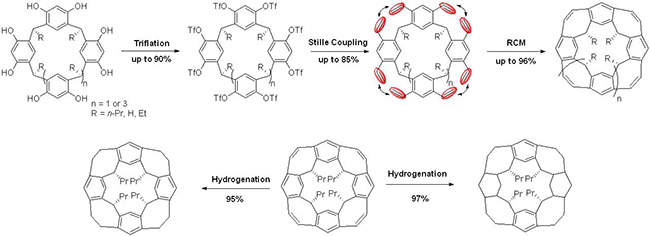
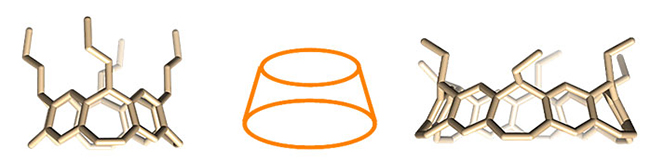
图 2. 圆台锥型环带[n]芳烃[n] 烯及衍生物的合成与结构
烯及衍生物的合成与结构
基于“跨湾造桥”策略在合成环带[n]芳烃[n] 烯中的成功表现,该团队将目光转向化学家们已经探索了几十年的梦想分子——环带[n]芳烃。从
烯中的成功表现,该团队将目光转向化学家们已经探索了几十年的梦想分子——环带[n]芳烃。从 唢[4]芳烃衍生物出发,经简单的官能团转化后,即可生成
唢[4]芳烃衍生物出发,经简单的官能团转化后,即可生成 唢[4]芳烃每个“湾区”含有单个异丙烯基与苄醇基的
唢[4]芳烃每个“湾区”含有单个异丙烯基与苄醇基的 唢[4]芳烃衍生物。然后通过分子内的“一锅”四重Friedel-Crafts烷基化反应获得不同取代基取代的氢化环带[8]芳烃。因芳基的取向不同,可以分离得到不同的非对映异构体。这类环带烃分子在晶体结构中展示出方型的环带状空腔,其中的环己二烯片段采取船式构象释放部分的张力(图3)。
唢[4]芳烃衍生物。然后通过分子内的“一锅”四重Friedel-Crafts烷基化反应获得不同取代基取代的氢化环带[8]芳烃。因芳基的取向不同,可以分离得到不同的非对映异构体。这类环带烃分子在晶体结构中展示出方型的环带状空腔,其中的环己二烯片段采取船式构象释放部分的张力(图3)。

图 3. 氢化环带[8]芳烃的合成与结构
继而,他们将“跨湾造桥”策略成功的延伸到更大尺寸环带烃类化合物的合成。以 唢[6]芳烃为原料,通过选择性甲基化获得两种不同结构的六甲基化
唢[6]芳烃为原料,通过选择性甲基化获得两种不同结构的六甲基化 唢[6]芳烃衍生物。避免了繁琐的分离与纯化,混合物直接转化为六三氟甲磺酸酯衍生物,通过Suzuki偶联合成得到含有丙烯基取代的中间体。也可通过与Zn(CN)2偶联引入氰基,随后经格氏反应与NaBH4还原生成芳香苄醇的中间体。两种中间体混合物分别经“一锅”六重Friedel—Crafts烷基化反应生成相应的氢化环带[12]芳烃产物。晶体衍射分析表明这类化合物有着纳米尺寸的六边型环带状结构和空腔(图4)。
唢[6]芳烃衍生物。避免了繁琐的分离与纯化,混合物直接转化为六三氟甲磺酸酯衍生物,通过Suzuki偶联合成得到含有丙烯基取代的中间体。也可通过与Zn(CN)2偶联引入氰基,随后经格氏反应与NaBH4还原生成芳香苄醇的中间体。两种中间体混合物分别经“一锅”六重Friedel—Crafts烷基化反应生成相应的氢化环带[12]芳烃产物。晶体衍射分析表明这类化合物有着纳米尺寸的六边型环带状结构和空腔(图4)。
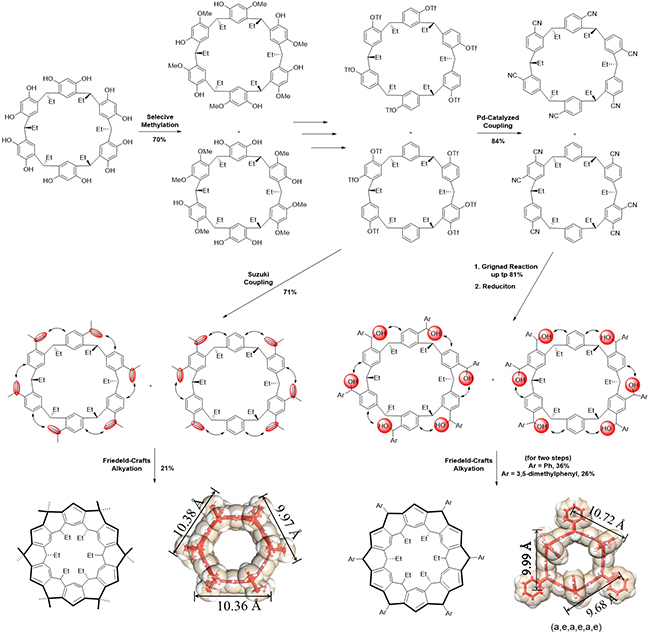
图 4. 氢化环带[12]芳烃的合成及其纳米尺寸空腔
为了合成全共轭的环带[8]芳烃,研究者们进一步探索了氢化环带[8]芳烃的氧化芳构化反应。发现当底物与DDQ试剂反应时,不仅使氢化环带[8]芳烃发生脱氢芳构化,所生成的高张力环带中间体还会进一步与体系中的DDQ发生[4+2]环加成反应,通过实验条件控制,得到了不同的环带烃与DDQ的加合产物。当在高活性的亲双烯体四氰基乙烯(TCNE)存在时,合成了环带烃与TCNE的加合产物,并实现了不同加合产物之间的化学转换(图5)。最后,他们探索了环带[8]芳烃的四DDQ加合物在不同条件下的逆Diels-Alder反应,以获得环带[8]芳烃目标分子。由于目标产物的不稳定性,他们虽然未能在常规的实验条件分离获得该产物,但是在MALDI质谱条件下,他们监测到了环带[8]芳烃的分子离子峰(图6),这也是历史上首次在实验上观察到环带[8]芳烃分子。
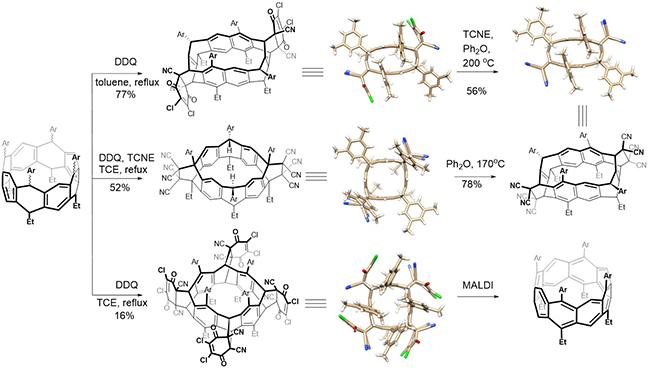
图 5. 八氢化环带[8]芳烃的氧化芳构化反应

图6. 环带[8]芳烃的MALDI-TOF质谱图以及理论优化的结构
有关环带[8]芳烃的研究发表在《美国化学会志》(J. Am. Chem. Soc. 2020, 142, 4576-4580.)上,清华大学博士生时谈浩与郭庆辉为本文的共同第一作者。有关环带[12]芳烃的研究发表在《德国应用化学》(Angew. Chem. Int. Ed. 2020, 59, DOI: 10.1002/anie.202002827.)上,清华大学博士生时谈浩为本文的第一作者。
研究工作获得国际同行的好评,环带[8]芳烃的研究工作被《美国化学会志》杂志选为封面文章,并推送了论文(图7A)。ChemistryViews等(图7B和7C)报道了他们的研究。近日,诺贝尔化学奖获得者司徒塔特(Stoddart)教授在Chem(https://doi.org/10.1016/j.chempr.2020.03.019)(图7D)杂志上撰写文章,评价了J. Am. Chem. Soc.论文工作,认为他们合成策略巧妙(“ingenious idea”);标志着碳纳米管中含有高张力的最简构筑单元设计和合成方面的一个突破(“The present work, which constitutes the first synthesis and observation of the belt[8]arene derivatives, represents a breakthrough in designing and synthesizing the simplest building blocks with extreme high ring-strain energies that are present in CNTs.”);该突破可能打开了锯齿形碳纳米管更加可控和精准合成之门(“This breakthrough could open doors to moor controlled and precise synthesis of zigzag carbon nanotubes”);对环带烃研究领域作出了一个重要贡献(“have made a significant contribution to the field of hydrocarbon belts”)。

图 7. 研究成果受到国际同行的广泛关注
本研究得到国家自然科学基金会和清华大学理科提升计划的资助。
论文链接:
https://pubs.acs.org/doi/10.1021/jacs.9b12181
https://pubs.acs.org/doi/10.1021/jacs.0c00112
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202002827
关键字: